08 Mar Qué se entiende por Off-label

Artículo de Natalia de la Figuera – Cofundadora y COO de GENESIS Biomed
· Los medicamentos off-label (fuera de etiqueta) son aquellos prescritos en condiciones distintas de las autorizadas
· El uso del off-label está más extendido en oncología, pediatría, enfermedades raras, psiquiatría, reumatología y hematología
· Pueden existir diferentes tipos de prescripción off-label: por indicación, por edad, por ruta de administración y por dosis
Los medicamentos o prescripciones on-label son aquellos medicamentos que son usados tal y como reflejan las características de su ficha técnica y en las indicaciones que aparecen en la misma. Estos medicamentos han sido aprobados por la Agencia del medicamento correspondiente y se ha evaluado el beneficio-riesgo. Es decir, en las condiciones de uso de la ficha técnica y en la indicación reflejada el beneficio supera a los riesgos, por lo que la agencia regulatoria ha aprobado su uso. Pero fuera de las condiciones allí reflejadas no existen la suficiente información para tomar decisiones.
De forma opuesta existen los medicamentos off-label (fuera de etiqueta), que son aquellos prescritos en condiciones distintas de las autorizadas, es decir, utilizados para un uso no reflejado en su ficha técnica y por lo tanto no cubierta por la agencia regulatoria para su comercialización para ese fin, porque no se han sometido al tipo de evaluación beneficio-riesgo necesario.
Aunque el uso de un medicamento off-label NO está regulado por la legislación de la UE, los profesionales sanitarios pueden considerar recetar un medicamento off-label cuando no hay un tratamiento disponible para el paciente o si un tratamiento disponible no ha sido efectivo. La prescripción off-label es parte de la práctica clínica y puede estar informada por evidencia científica fiable. El uso off-label es más común entre ciertas poblaciones de pacientes, las áreas en las que está más extendida son:
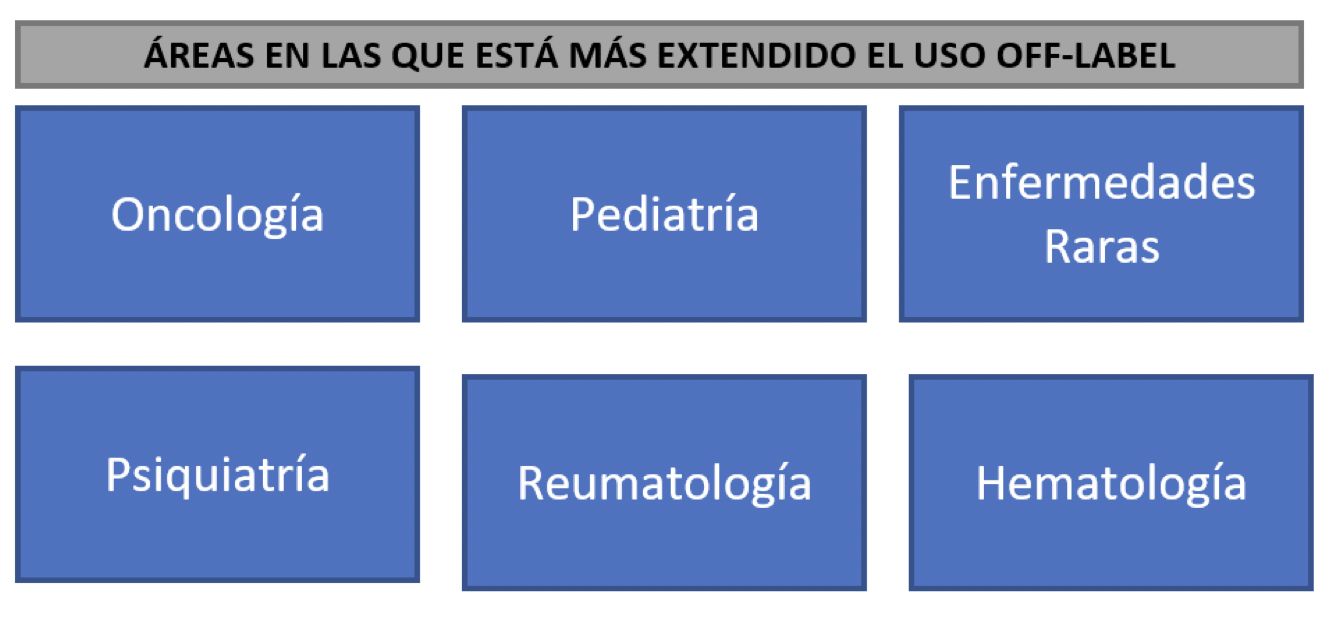
A continuación, se explica algunos ejemplos de por qué es relevante su uso en algunas de ellas:
Off-label en Oncología:
El uso de medicamentos no aprobados está más extendido en oncología que en otras áreas médicas por varias razones, pero la razón principal es por la gran cantidad de tipos de cáncer diferentes. Las determinaciones genéticas demuestran similitudes en mutaciones de cánceres diferentes, que hace que un medicamento contra un cáncer pueda ser útil en otros tipos de cáncer para los que no ha sido aprobado.
Off-label en Pediatría:
Muchas prescripciones pediátricas son off-label, la razón es que muchos medicamentos no fueron aprobados para su uso en poblaciones pediátricas y, por lo tanto, no están autorizados para su uso en niños. Los ejemplos más comunes de uso off-label en niños son los medicamentos que se prescriben en una dosis o frecuencia diferente a la indicada para adultos. También hay casos en los que los niños reciben un medicamento para una indicación diferente o por una vía alternativa. El porcentaje de off-label varía en pediatría, pero oscila entre el 20 y el 80% de todas las prescripciones. Para regular su utilización el 26 de Enero de 2007 el Reglamento Pediátrico entró en vigor en la UE para abordar el problema del off-label en pediatría. El reglamento tiene como objetivo mejorar la salud de los niños en Europa facilitando el desarrollo y la disponibilidad de medicamentos para niños de 0 a 17 años. En ese reglamento se establece que una empresa debe presentar un Plan de Investigación Pediátrica (PIP) para cada medicamento que desee desarrollar. Esto garantiza que los medicamentos sean de alta calidad, que se investiguen éticamente y que estén debidamente autorizados, reduciendo el off-label en este rango de población.
Como se ha visto en el ejemplo de pediatría, existen diferentes tipos de prescripción off-label que se pueden producir clínicamente como puede ser: por indicación, por edad, por ruta de administración y por dosis. En la Tabla de debajo se indica los diferentes modos de prescripción de medicamentos y los usos o modalidades diferentes del off-label.
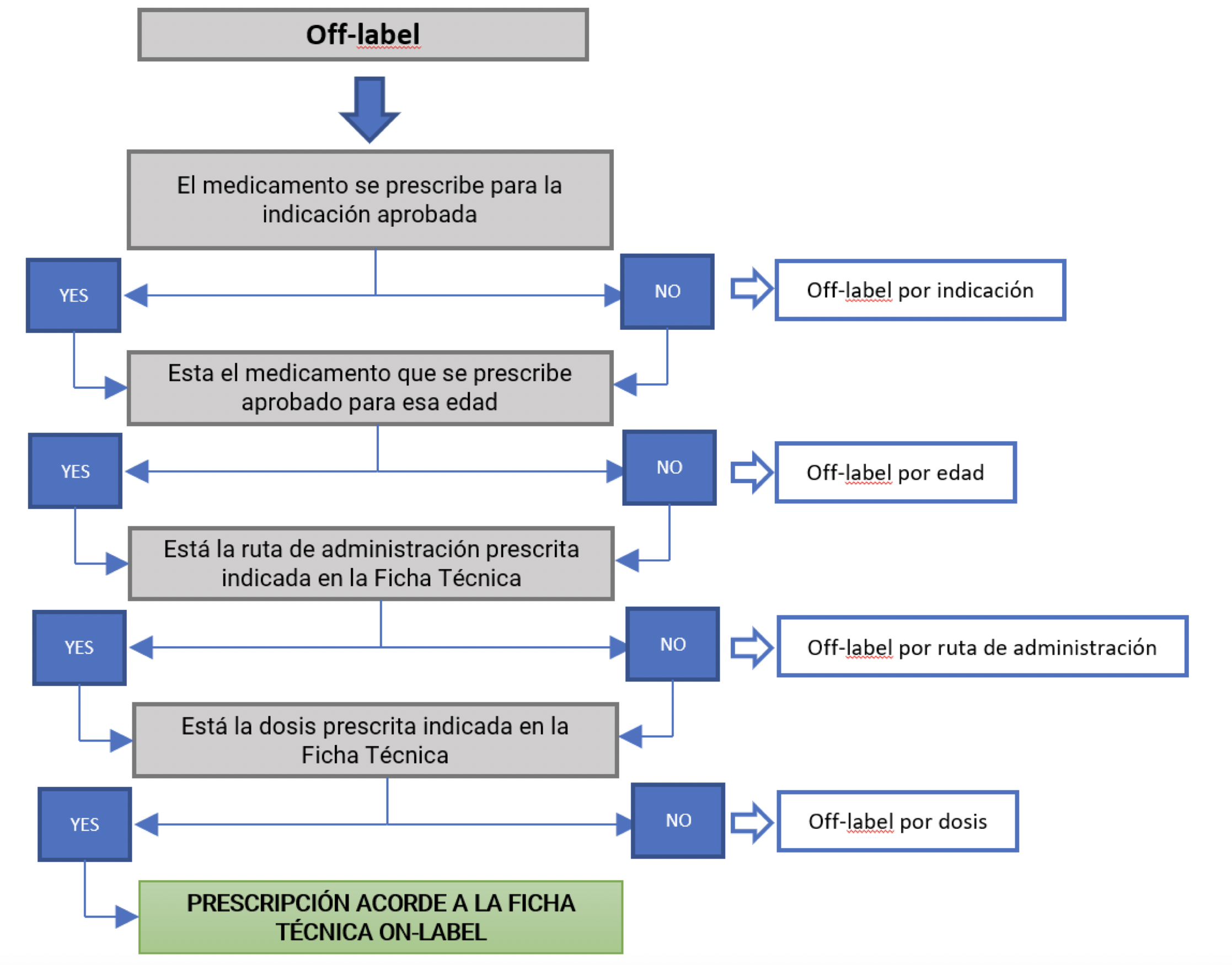
Los usos de medicamentos off-label dentro de la esfera de la práctica clínica no requieren una autorización caso por caso según el Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. Pero su uso tendrá carácter excepcional y se limitará a las situaciones en las que se carezca de alternativas terapéuticas autorizadas para un determinado paciente. No obstante, es necesario justificar convenientemente en la historia clínica la necesidad del uso del medicamento. Informar al paciente en términos comprensibles, de la naturaleza del tratamiento, su importancia, implicaciones y riesgos, y obtener su consentimiento. También hay que notificar las sospechas de reacciones adversas al sistema de Farmacovigilancia. Al recetar un medicamento fuera de etiqueta, los profesionales sanitarios son responsables de cualquier problema que surja del uso del medicamento y no la compañía farmacéutica.


